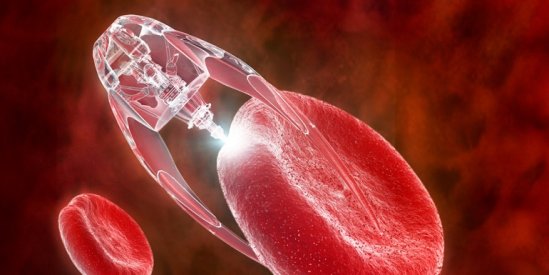
Des chercheurs de l’université Johns Hopkins se sont inspirés du travail des parasites pour l’administration de médicaments. Les « Theragrippers » sont de minuscules machines dont la forme change et qui délivrent efficacement des médicaments dans le tube digestif.
S’inspirant d’un ver parasite qui enfonce ses dents acérées dans les intestins de son hôte, des chercheurs de Johns Hopkins ont conçu de minuscules microdispositifs en forme d’étoile qui peuvent s’accrocher à la muqueuse intestinale et libérer des médicaments dans l’organisme.
JHU.edu
David Gracias, professeur de génie chimique et biomoléculaire, est connu pour la conception, le développement et la caractérisation de dispositifs miniaturisés, de matériaux et de systèmes intelligents. Nombre de ces dispositifs et systèmes sont bien plus petits que ce qui peut être visualisé à l’œil nu ou même au microscope optique, ce qui les rend particulièrement difficiles à assembler et à caractériser.
L’approche pluridisciplinaire de M. Gracias s’appuie sur la fabrication conventionnelle de puces microélectroniques ainsi que sur la biofabrication et de nouveaux processus d’auto-assemblage. Son laboratoire est réputé pour l’utilisation d’éléments issus des mondes biotique (bactéries, cellules) et abiotique (optique, électronique) afin de créer des structures bioniques.
JHU.edu
Administrer des médicaments grâce aux aimants
Ce projet tent à développer un nouveau biomatériau auto-assemblé « intelligent » contenant des assemblages supramoléculaires de nanoparticules et de vésicules magnétiques (MNPV) en tant qu’éléments actifs, capables de convertir des signaux magnétiques non invasifs en réponses biochimiques dans les cellules. Ce nouveau biomatériau présentera une meilleure biocompatibilité et permettra un contrôle spatio-temporel de la libération de composés bioactifs par les MNPV dans l’hydrogel. Pour parvenir à ce contrôle temporel, un mécanisme de double libération sera intégré au biomatériau de sorte qu’une impulsion magnétique de courte durée libérera un composé bioactif et provoquera une réponse cellulaire, suivie d’une impulsion magnétique « d’autodestruction » de plus longue durée qui libérera des enzymes/réactifs capables de dissocier les MNPV et l’hydrogel qui les entoure. Les liaisons non covalentes et enzymatiquement clivables entre les nanoparticules et les vésicules magnétiques et dans les matrices d’hydrogel seront analysées. Ce second signal « d’autodestruction » facilitera l’élimination non invasive de l’hydrogel synthétique in vivo ou in vitro sans endommager mécaniquement les cellules. Pour parvenir à un contrôle spatial, l’hydrogel sera modelé magnétiquement à l’échelle macro et micro au cours de la préparation des gels de vésicules.
En outre, pour accroître l’hospitalité des biomatériaux préparés à travers les types de cellules et cibler les MNPV sur certaines lignées cellulaires, des glycolipides et des lipopeptides seront synthétisés chimiquement/chimioenzymatiquement et dopés dans les MNPV. Tout au long du projet, chaque biomatériau magnétiquement réactif sera testé en tant que plateforme de culture cellulaire, l’effet des composés libérés sur les cellules étant évalué à l’aide de tests standard, tels que le comptage des cellules, le MTT pour l’activité métabolique, les tests ADN pour la prolifération cellulaire, la cytométrie de flux et la PCR en temps réel. L’obtention d’un contrôle spatio-temporel sur les cellules cultivées dans ces biomatériaux auto-assemblés « intelligents » ouvrira la voie à des applications potentielles passionnantes dans le domaine de l’ingénierie tissulaire et de la médecine régénérative.
Des chercheurs ont développé des biomatériaux intelligents qui peuvent administrer des médicaments aux tissus malades à un moment spécifique, contrôlés par un déclencheur magnétique à distance.
Les agrégats de vésicules/nanoparticules magnétiques (VNPM) sont des systèmes d’administration de médicaments microscopiques qui émettent leur contenu suite à un signal magnétique. Les particules d’environ un milliardième de mètre sont attachées à des vésicules lipidiques de médicaments, qui sont intégrées à un hydrogel.
Dans des applications comme la médecine régénérative et le génie tissulaire, les VNPM doivent administrer des médicaments ou tout autre matériau bioactif à un site malade au bon moment. Pour ce faire, les chercheurs ont transformé les VNPM en biomatériaux intelligents magnétiquement sensibles dans le cadre du projet financé par l’UE intitulé MAGNANOVES (Magnetically responsive nanoparticle-vesicle hydrogels as « smart » biomaterials for the spatiotemporal control of cellular responses).
L’idée au cœur du projet MAGNANOVES était de rendre les VNPM capables d’administrer des médicaments une fois exposés à un champ magnétique et de s’autodétruire une fois la charge administrée. Après avoir déterminé comment attacher chimiquement les nanoparticules magnétiques aux vésicules lipidiques, les chercheurs ont développé des méthodes pour administrer magnétiquement les médicaments des VNPM en suspension.
L’un des objectifs impliquaient l’émission de deux molécules travaillant en collaboration pour inciter une réaction cellulaire, par exemple, une enzyme et son substrat. En émettant magnétiquement de la trypsine, une enzyme de digestion, dans une solution de protéines, les chercheurs ont démontré que de grosses molécules peuvent être administrées par des VNPM en suspension au lieu des gels conventionnels. Le fait que la trypsine reste active et digère les protéines démontrait le potentiel du système pour administrer des enzymes aux cellules afin d’induire une réaction cellulaire.
Dans une autre innovation, les chercheurs ont attaché des protéines et des enzymes sur la surface de particules magnétiques. Cette méthode pourrait être utilisée pour convertir un pro-médicament inactif en une forme active après qu’il soit magnétiquement administré par un système de VNPM.
Bien que les chercheurs aient encore à surmonter plusieurs obstacles, le système de vésicules/nanoparticules de MAGNANOVES est très prometteur en matière d’administration de traitements aux cellules sans affecter les tissus environnants. Après avoir démontré le fonctionnement de leur système d’enzyme/substrat, cette méthode peut être aussi étudiée pour développer des biocapteurs et des catalyseurs industriels.